作为带量采购的入门券,仿制药一致性评价加快了中国医药产业的优胜劣汰,对提升中国药品行业整体质量的作用不言而喻;药品集中采购则是在保障质量的前提下,实现价格层面的“挤水”。从“4+7”试点到全国扩围,中标产品价格一降再降,多个药品给出“白菜价”,带量采购约定的市场份额足够诱人,企业自然愿意以价换量,国家医保资金压力也大大减少。
杂质谱一致、稳定性一致、体内外溶出规律一致,一致性评价要求仿制药品与原研药品质量与疗效一致。对于仿制药占据九成份额的国内医药市场来说,这无疑事关人民群众的用药安全,也事关医药行业的长远发展。在一致性评价持续推进的过程中,国家对于仿制药质量提升关注度前所未有,政策等多个层面都在进行强有力的推动,加快我国由制药大国向制药强国的跨越是政策层面的初衷之一。
在一致性评价持续推进的过程中,带量采购应运而生。继2018年12月“4+7”城市药品集采之后,2019年9月又实现全国集采,甚至相较于“4+7”试点,扩围后的中标药品均价再次下降。价格一降再降,不少药品的价格也达到诚意十足的“白菜价”。对于刚刚“烧钱”通过一致性评价,便在集采中低价中标的企业而言,利润如何保障成为关键,这背后更关系到集采后的药品供应问题。如果供应得不到保障,集采带来的改变也就无从谈起。正如一位不愿透露姓名的企业人士所言,集采过后,在一定程度上挤掉了以往药品流通等过程中的“水分”,企业的成本也变相降低,相较于现有的价格和市场,保障供应不成问题。
或许这只是企业的一家之谈,但对于整个中国医药产业来说,一致性评价和集中采购带来的改变,已经在悄然发生。目前,第三轮带量采购即将开始,品种扩大至35个的消息流出,包括仿制药在内的中国药品行业或将迎来新的格局。
【名词解释】
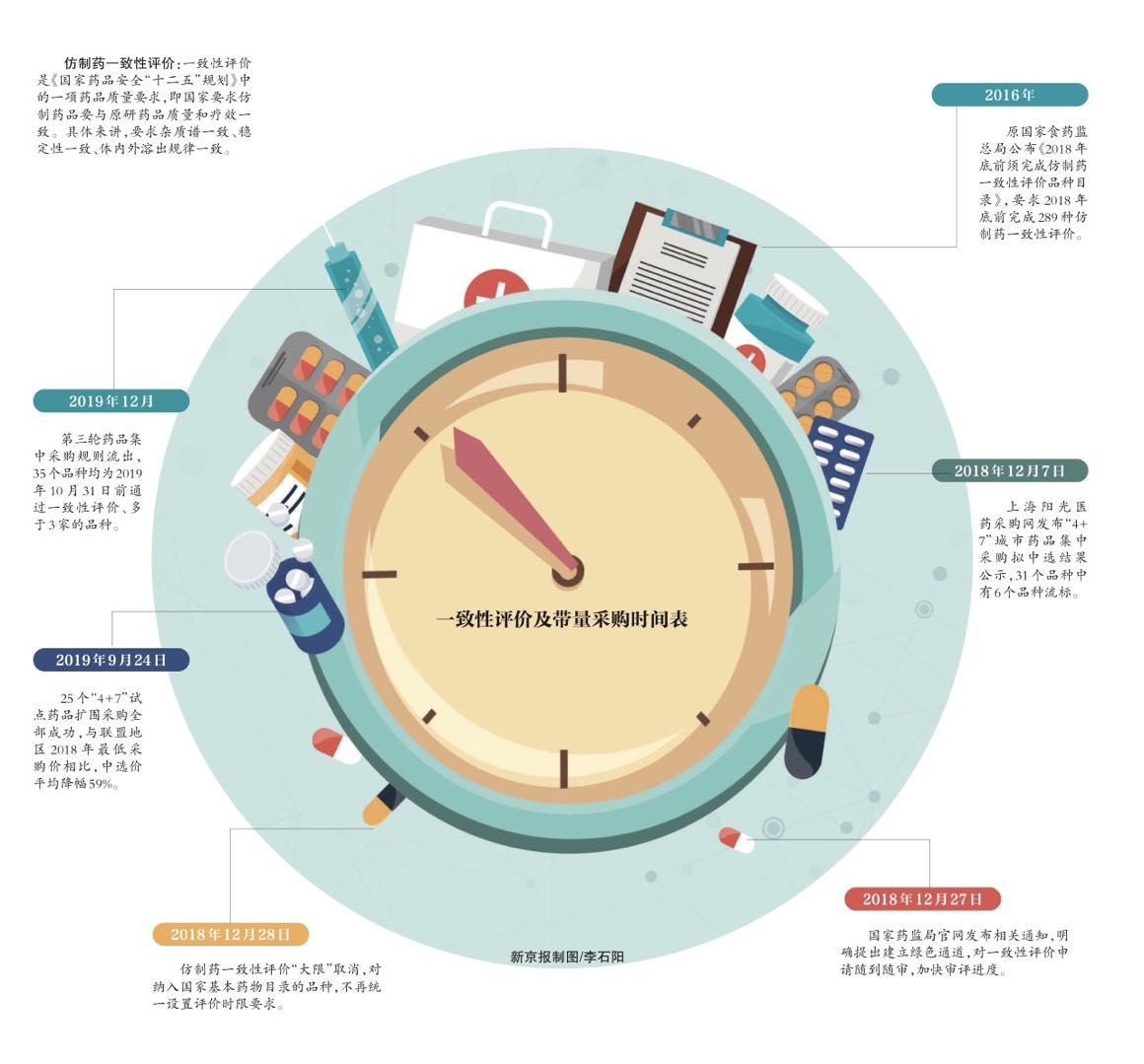
仿制药一致性评价:这是《国家药品安全“十二五”规划》中的一项药品质量要求,即国家要求仿制药品要与原研药品质量和疗效一致。具体来讲,要求杂质谱一致、稳定性一致、体内外溶出规律一致。
一致性评价及带量采购时间表
2016年:原国家食药监总局公布《2018年底前须完成仿制药一致性评价品种目录》,要求2018年底前完成289种仿制药一致性评价。
2018年12月7日:上海阳光医药采购网发布“4+7”城市药品集中采购拟中选结果公示,31个品种中有6个品种流标。
2018年12月27日:国家药监局官网发布相关通知,明确提出建立绿色通道,对一致性评价申请随到随审,加快审评进度。
2018年12月28日:仿制药一致性评价“大限”取消,对纳入国家基本药物目录的品种,不再统一设置评价时限要求。
2019年9月24日:25个“4+7”试点药品扩围采购全部成功,与联盟地区2018年最低采购价相比,中选价平均降幅59%。
2019年12月:第三轮药品集中采购规则流出,35个品种均为2019年10月31日前通过一致性评价、多于3家的品种。
新京报记者 张秀兰
编辑 岳清秀 校对 翟永军









