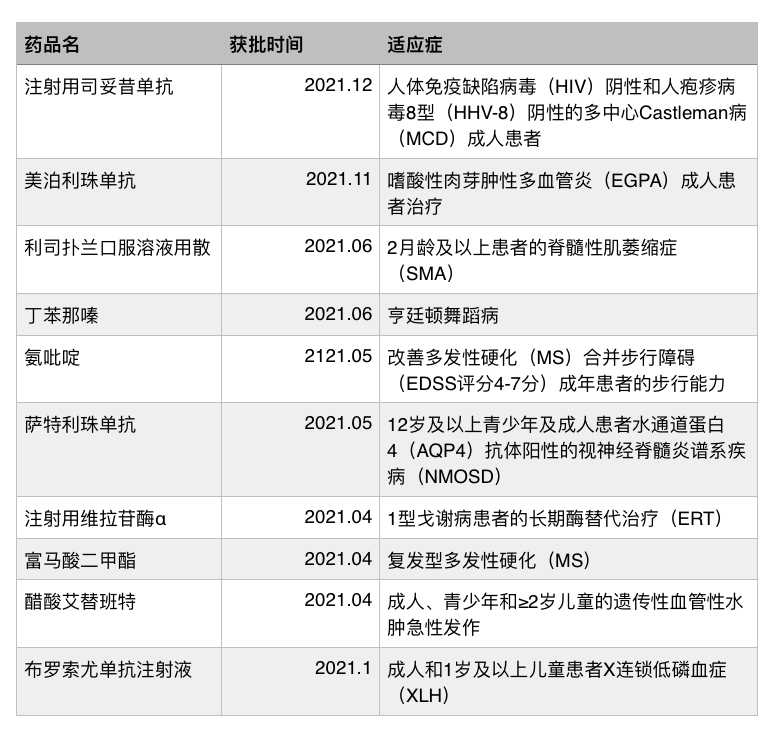
新京报讯(记者 张秀兰)“在所有药品上市申请中,罕见病药物审评审批时限最短。”在12月18日举行的2021年中国罕见病大会上,国家药监局副局长陈时飞介绍,今年已有利司扑兰口服溶液用散、布罗索尤单抗注射液等10个罕见病药品获批上市,用于治疗脊髓性肌萎缩症、青年帕金森、高氨血症等。
国家药监局不断优化审评审批程序,加快罕见病新药上市速度。2020年,新修订的《药品注册管理办法》明确,将具有明显临床价值的防治罕见病的创新药和改良型新药纳入优先审评审批程序,对于临床急需的境外已上市境内未上市的罕见病药品在70日内审结。
国家医疗保障局副局长李滔指出,截至目前,国内共有60余种罕见病用药获批上市,其中已有40余种被纳入国家医保目录,涉及25种疾病。通过对罕见病药品的谈判准入,大幅度降低罕见病用药的价格,今年共有7个罕见病药品谈判成功,平均降幅达65%,尤其是脊髓性肌萎缩症(SMA)注射液大幅降价纳入目录,从年均70万的天价调整至3万多的平民价,再加上医保报销,基本上可以解决脊髓性肌萎缩症(SMA)患者的负担。
大会期间,中国红十字基金会与中国罕见病联盟共同发起的 “罕见病共助基金”发布。该基金致力于资助因疾病而经济负担较重的罕见病患者、培训罕见病医师、支持与罕见病有关的研究和技术开发、开展罕见病知识科普等公益项目。
10个罕见病药品获批上市
校对 卢茜












